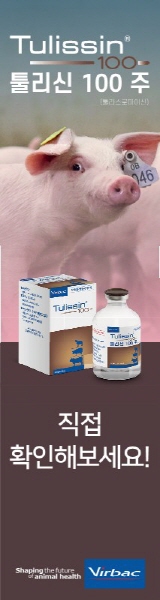
![PRRS 바이러스(화살표)는 40~60nm 크기의 바이러스로 번식장애와 호흡기 질환을 유발합니다. [사진 출처: 수의전자현미경도감, 2006]](http://www.pigpeople.net/data/photos/20170727/art_14995950435705_07b5b9.jpg)
어느덧 PRRS가 국내 보고된 지 30년이 되어 갑니다. 그 동안 양돈농가에 끼친 막대한 피해야 두말할 필요도 없지만, 안타깝게도 아직 이 질병을 통제할 뚜렷한 해법이 있는 것은 아닙니다. 우리나라 양돈 농가에 치명적이었던 돼지 콜레라나 돈적리 같은 질병들도 어느 정도 통제에 성공했는데 왜 이토록 PRRS 바이러스는 통제하지 못했을까요?
필자의 의견으로는 '안전하고 효과적인 백신이 없기 때문'이라 생각합니다.
사실 써코바이러스의 사례에서 보듯이 효과적인 백신이 존재한다면 PRRS도 제압이 가능합니다. 다만 지금은 그런 백신이 없는 게 문제입니다.

오랫동안 백신 개발분야의 눈부신 성과를 바탕으로 연구자들은 PRRS에 관한 논문을 한해 수십 편씩 쏟아내고 있지만, 아직까지 만족할 만한 해답을 찾아내지 못하고 있습니다. 그래서 오늘은 왜 이렇게 PRRS는 효과적인 백신 개발이 어려운지를 살펴보고 현재 개발 중인 백신의 개발 방향과 적용된 최신의 기술을 고찰해보고자 합니다.
특별히 생독 백신에 초점을 맞추고자 하는데 글의 내용이 비록 양돈 농가에 계시는 생산자분들의 입장과는 다를지라도 바이러스를 보다 깊이 이해하고 농장에서 백신을 사용하는데 조금이라도 도움이 될 만한 내용 위주로 기술하였습니다.
완벽한 백신 개발이 어려운 이유- PRRS 바이러스의 특징

1. 높은 변이성과 교차면역
많은 분들께서 알고 계시듯이 PRRS는 RNA 바이러스입니다. 보다 세부적으로 그 중에서도 Positive sense(플러스 가닥) 형입니다. 이 계열에 속한 바이러스들은 대체로 높은 변이율을 보이는데 이는 RNA 자체의 구조적 취약성 때문입니다. 그래서 구조적으로 안전한 써코바이러스 같은 DNA 바이러스 보다 월등히 높은 변이율을 보입니다.
흥미로운 사실은 과거와 달리 최근에 PRRS의 변이율은 점점 더 빨라지고 있다는 점입니다[1]. 현재 북미형은 9개의 lineage(계통)로 분류하고 유럽형은 4개의 subtype(아형)으로 분류하는데 각각의 그룹 하위 영역에서 바이러스의 변이가 빠르게 진행되어 새로운 변종의 출현이 잦은 편입니다. 또 단순히 염기서열 몇개가 변하는 게 문제가 아니라 항원인 아미노산이 바뀌면 바이러스의 병원성 및 면역원성까지도 바뀔 수 있습니다.
이러한 높은 변이율과 바이러스 간의 서로 다른 면역원성은 백신이 방어할 수 있는 교차면역의 영역을 피하는 균주가 얼마든지 존재할 수 있게 해줍니다. 이런 상황에서 하나의 균주로 만들어진 백신으로 너무나도 다양한 농가의 모든 PRRS를 방어하는 것은 대단히 어려울 수 밖에 없습니다.
2. 숙주 면역계 교란
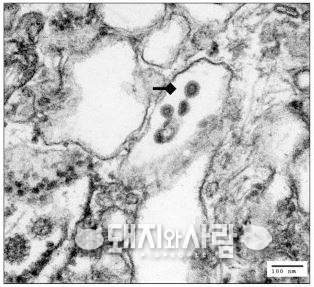
여타의 바이러스와 달리 PRRS가 가진 강력한 특징은 감염 초기 숙주의 면역계를 교란해 바이러스에 대항할 면역력이 생기는 것을 억제시킨다는 점입니다. 최근에도 지속적으로 내용이 업데이트 되고 있는데 간략하게 몇 가지를 정리하면 다음과 같습니다.
a. 감염초기 Type I IFN (Interferon) 분비 억제
바이러스라는 것이 세포에 기생하는 일종의 '기생충' 같은 존재인데, 감염된 세포는 IFN(인터페론)이란 물질을 내뿜으면서 자신의 감염 사실을 면역계에 전달하고 후속조치를 요구합니다. 이 사실을 면역계가 인지하면 전투준비에 돌입하고 실제적인 전투를 치루는 시스템입니다.
따라서 감염 초기에 세포에서 분비되는 IFN은 면역반응의 시발점이라 할 수 있습니다. PRRS는 감염된 세포에서 이런 IFN의 분비를 억제할 여러가지 기전이 있습니다. 때문에 IFN의 분비가 억제되면서 면역계의 작동이 늦어지고 전반적인 반응도 약합니다. 어찌보면 바이러스가 '대단히 영리하다' 할 수 있습니다.
b. 항원 제시 억제
면역계가 외부 침입자를 인식하면 녀석의 항원을 '암살부대'라 할 수 있는 백혈구들에게 보여줍니다. 이 과정을 항원제시(antigen presenting)라고 합니다. 쉽게 설명하면 경찰이 피의자의 몽타주를 동료 경찰들에게 보여주고 브리핑하는 것과 비슷합니다. 문제는 PRRS는 자신의 몽타주를 경찰이 브리핑하는 것을 교묘하게 억제할 수 있습니다. 이렇게 되면 백혈구들이 바이러스의 항원 자체를 인식하는 것이 어려워질 수 있습니다.
c. 중화항체 생성 억제
항체는 병원체의 소멸에 중요한 역할을 하지만, PRRS의 경우에는 감염이 이후 매우 느리게 생성됩니다. 물론 일반적인 ELISA 항체가는 높게 나오지만 이때 생성된 항체가 실제로 바이러스를 방어하는 중화능력을 보유한 항체는 아닙니다. 사실 PRRS의 경우 ELISA 항체가와 중화항체가 비례 관계인 것이 아닙니다.
그렇다면 왜 생성된 항체가 중화능력이 없을까요? 이유는 바이러스가 중화항체가 생기는 것을 교란하기 때문입니다. 가장 대표적인 기전은 중화항체가 붙는 자리 주변에 면역원성이 높은, 다시 말해 항체가 생기기 좋은 decoy epitope(미끼 항원결정부)라는 것이 존재하기 때문입니다.

조금 어려운 용어인데 간단히 설명하면 이 decoy epitope는 실제로 중화항체로 인식될 수 있는 부위가 면역계에 노출되는 것을 억제하는 작용을 합니다. 때문에 PRRS 감염 이후 중화항체는 비교적 느리게 생성되는 편입니다.
중요한 점은 이러한 숙주 면역계를 방해하는 특성을 생독 백신도 동일하게 보유한다는 것입니다. 대개 생독 백신 균주는 자신의 조상 바이러스의 특성을 비슷하게 공유하는데 비록 약독화 되었을지라도 면역계를 억제하는 조상 바이러스의 특성을 백신 균주도 보유하고 있습니다. 이것이 생독백신의 효능이 떨어지는 이유 중의 하나입니다. 또 백신이 제대로 된 면역력을 유도하는데 몇 주 이상 오랜 기간이 소요되는 이유이기도 합니다.
![Transfection machine; 전기로 세포에 자극을 줘서 유전물질을 인위적으로 삽입이 가능합니다. [사진 출처: 바이오포아]](http://www.pigpeople.net/data/photos/20170727/art_14995948754553_ca1a79.jpg)
완벽한 PRRS 백신 개발을 이룰 차세대 기술
백신 개발이 어려운 이유를 몇가지 살펴보았는데 이번에는 그런 문제를 해결하기 위해 시도되는 첨단 기술들을 소개하고자 합니다.
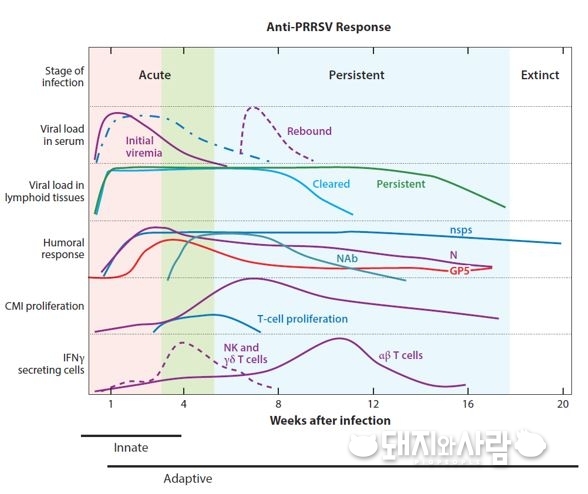
1. Reverse genetics system (역유전학 기술)
Reverse genetics system은 우리말로 ‘역유전학’이라 합니다. 이 기술은 바이러스의 전체 유전자 서열을 확인해서 실험실에서 재조합된 인공적인 바이러스를 만들어내는 것입니다. 최근 눈부신 기술의 발달로 이미 다양한 바이러스가 인공적으로 합성되어 만들어졌는데, PRRS의 경우 1998년에 최초로 백신 개발을 위해 만들어진 이래로 제가 몸담고 있는 '바이오포아(대표 조선희)'를 포함한 다양한 연구소에서 제작하고 있습니다[2].
이 역유전학 기술의 최대 장점은 인공적으로 바이러스를 합성하기 때문에 바이러스 유전자에 원하는 대로 여러 조작을 가해줄 수 있다는 점입니다. 아래에서 설명할 chimeric virus(키메라 바이러스)나 codon pair deoptimization 등 여러 기전을 바이러스의 유전자에 탑재하여 조작된 새로운 바이러스를 만들어 낼 수 있습니다.
연구자들의 관점에서 보면 기존의 세포 계대를 통한 약독화 방법과 달리 인공적으로 연구자가 원하는 대로 바이러스를 조작할 수 있고 그 특성을 극대화할 수 있다는 장점이 있어 생독 백신의 개발에서 빠질 수 없는 기술입니다.
2. DIVA-marker vaccine
DIVA (Differentiating Infected from Vaccinated Animals), 디바 백신의 개념은 이름 그대로 백신을 접종해서 유도된 항체와 감염으로 인해 생긴 항체가 달라, 이를 바탕으로 항체가 생긴 동물이 백신 때문인지, 아니면 감염 때문인지를 구분할 수 있게 고안된 것 입니다. 이런 것이 가능한 백신이라면 여러가지 장점이 있는데 소위 말하는 ‘물백신’ 의심도 단번에 제거할 수 있고 감염된 돼지에 대한 보다 자세한 추적도 가능합니다.
DIVA 개념이 적용된 백신은 인플루엔자나 돼지 열병 등 여러 질병 백신에서 시도하고 있는데, 최근 PRRS 생독백신도 이러한 DIVA 개념이 적용된 백신의 출시가 임박했다고 합니다. 다만 ELISA의 민감도를 고려하면 정말 정확하게 구분이 되는지는 조금 더 검증할 필요가 있을 듯합니다.
3. Chimeric virus
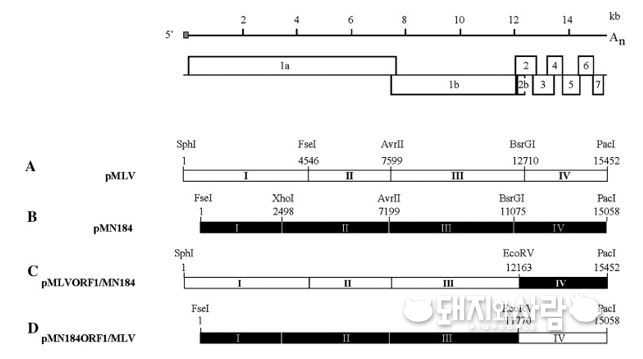
소위 말하는 ‘키메라’는 그리스 신화에서 나오는 상반신이 사자이고 하반신이 뱀인 괴물을 뜻한다고 합니다. 이름만 들어도 이 용어가 의미하는 것이 뭔가를 합체한 것과 관계 있다고 짐작할 수 있습니다. 보다 쉽게 설명하자면 프랑켄슈타인처럼 여러 사람의 장기를 하나의 신체에 조립해서 만들어 낸 것과 같다고 할 수 있습니다.
예를 들어 A, B 두 바이러스의 유전자를 서로 조립해서 하나의 키메라 바이러스를 만들어 내는 것인데 인공적으로 재조합해서 만드는 것이기에 당연히 앞서 설명한 역유전학을 이용하는 것입니다. 사실 굳이 이런 방법을 사용하는 이유는 PRRS가 가지는 무지막지한 변이율과 다양한 면역원성을 커버할 교차면역의 영역을 조금이라도 넓히고자 하기 때문입니다. 앞서 예로 들었던 A, B 두 바이러스가 서로 교차면역이 되지 않더라도 A+B 합체한 키메라 바이러스는 두 바이러스에 대해 각각 교차면역이 될 수도 있습니다. 이런 식으로 PRRS에서도 교차면역을 넓혀서 보다 다양한 균주에 대한 방어 효능을 보유하게 하려는 것입니다.
4. Consensus virus
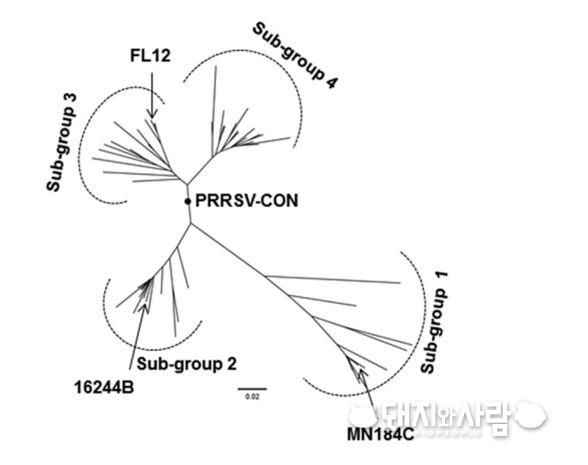
위의 그림에서 보듯이 계통수 상에서 여러 갈래로 나뉜 바이러스들 가운데 위치한 바이러스(‘PRRSV-CON’이라 표기된 바이러스)가 존재할 수 있습니다. 이론적으로 이런 바이러스는 계통에 속한 휘하의 여러 바이러스들과 공통으로 공유하는 항원이 있을 수 있고 서로 교차면역이 될 가능성이 높습니다. 이런 바이러스를 consensus virus라 합니다.
현재 분리된 PRRS 바이러스를 기반으로 계통수를 그리면 계통수 상에서 이런 consensus virus를 찾을 수 있고 이 바이러스는 동일 계통에 속한 바이러스들에 대해서는 보다 넓은 교차면역을 유도할 가능성이 높습니다. 생독 백신의 후보 균주로서 이러한 consensus virus는 꽤 매력적이라 여러 연구가 진행중입니다.
5. Type I IFN secreting virus
앞서 설명한 것처럼 PRRS 감염 초기 type I IFN 분비 억제는 바이러스의 숙주 면역계에 지대한 영향력을 미치는 만큼 연구자들이 항상 주목하는 부분입니다. 이러한 Type I IFN 분비를 억제하는 기전을 무력화시킬 수 있는 방법이 몇 가지 있는데, 그 중 하나는 PRRS의 NSP 단백질에 변이를 일으키는 것입니다.
사실 이 NSP 단백질의 여러 기능 중 하나가 IFN 분비 억제이기 때문에 이 부위에 변이를 일으키면 단백질의 억제 기전이 무력화 될 수 있습니다. 역유전학을 이용한 일련의 실험에서 연구자들은 억제 기전을 무력화 시킬 수 있는 부위를 찾아냈습니다.
또 연구자들이 찾아낸 몇몇 균주는 자연적으로 여타의 PRRS와는 다르게 숙주의 IFN 분비를 억제하는게 아니라, 도리어 강화 시킨다는 것을 발견했습니다. 이런 균주들을 생독 백신으로 사용하면 보다 강력한 면역력을 유도해 낼 수 있을 것으로 기대를 모으고 있습니다.
6. NGS (Next Generation Sequencing)
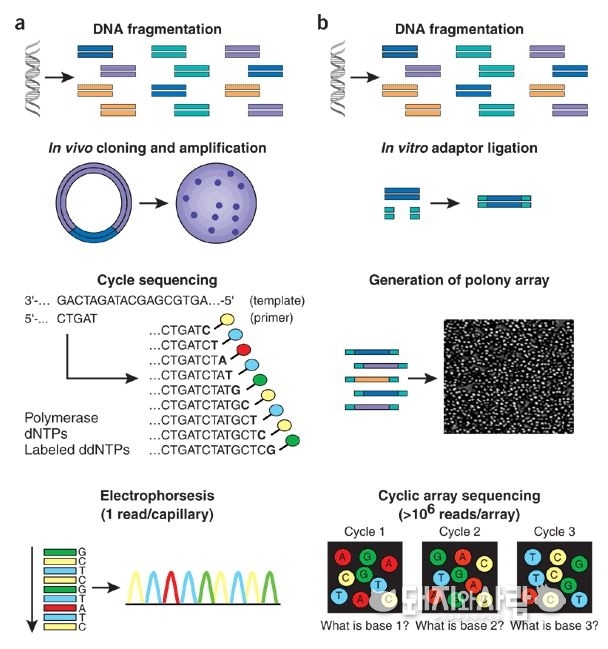
굳이 PRRS 백신뿐만 아니라 다방면에서 기대를 모으는 기술입니다. 이 기술이 얼마나 혁신적인 기술이냐면, 기존 시퀀싱 방법을 이용한 인간 게놈 프로젝트가 30억 염기서열을 해독하기 위해 약 13년간 30억달러의 비용이 투입되었는데, NGS 기술을 이용하면 동일한 염기서열을 해독하는데 10,000 달러로 2주 내 가능합니다.
한 번에 대량의 염기서열을 생산해 냄으로써 시간과 비용을 획기적으로 줄일 수 있습니다. 또한 기존의 방법으로는 탐지할 수 없는 다양한 유전체 변이를 NGS는 정확하게 탐지해 낼 수 있고, 탐지할 수 있는 변이의 민감도도 더 좋은 편입니다. 더구나 NGS의 기술은 계속 발전하고 있는 추세입니다.
![PCR 장비들 [사진 출처: 바이오포아]](http://www.pigpeople.net/data/photos/20170727/art_1499594845896_36b91f.jpg)
현재 양돈분야에서 진단으로 바이러스 항원을 탐지하는 기술은 거의 PCR 정도인데 이 방법은 샘플에서 타겟이 되는 항원의 유무 정도만을 확인할 수 있습니다. 반면 앞서 설명 드린 NGS기술은 샘플 내 존재하는 모든 DNA를 전부 시퀀싱 할 수 있습니다. 쉽게 설명하면 기존의 PCR로는 농장에서 보낸 샘플에 PRRS 북미형 혹은 유럽형 항원이 존재하는지 확인하는 수준이었다면 이제 NGS를 이용하면 샘플의 모든 바이러스 및 세균의 유전자가 통째로 심지어 전체 genome까지도 서열이 낱낱이 확인할 수 있는 것입니다.
유전자 변이, 계통, 백신주와의 구분, 그리고 recombination 여부까지 아주 상세한 정보가 단번에 빠르게 제공될 수 있는 것인데, 이러한 정보 자체가 바이러스에 대한 보다 깊은 이해가 가능하게 해주고 농가의 역학적 상황을 보다 상세히 알 수 있게 해줄 것으로 기대되고 있습니다.
7. Codon Pair Deoptimization
Codon pair deoptimization은 개념이 다소 어려울 수 있는데 쉽게 설명하면 유전자를 구성하는 codon(코돈)끼리 일종의 편향성('선호도'라는 표현이 더 나을 수도 있을 것 같습니다)이 존재한다는 데 착안한 약독화 방법입니다.
컴퓨터 프로그램을 이용하여 이 편향성을 낮추면 바이러스의 아미노산 발현 자체가 떨어지면서 약독화될 수 있다는 것이 요지입니다(정확한 기전은 따로 문의주시면 자세히 설명 드리겠습니다). 실제로는 논란의 여지가 있긴 하지만, 약독화 자체는 이미 여러 바이러스에서 적용되어 성공한 바 있고 PRRS의 경우에도 최근에 성공하였습니다[3].
이 방법의 장점은 기존의 세포 계대 방식에 비해 아주 빠르게 역유전학을 이용하여 약독화된 균주를 만들어 낼 수 있다는 점입니다. 필자의 경험으로 정말 일사천리로 작업하면 한 달 만에 약독화 된 균주를 만들어 낼 수 있는데 1~2년 정도 소요되는 세포 계대에 비해 아주 빠릅니다. NGS가 보다 보편적인 기법으로 확립되면 미래에는 농가에 유행하는 균주를 맞춤형으로 codon pair deoptimization기전으로 약독화된 백신을 빠르게 생산할 수 있을 것으로 예상됩니다.

정리하면 최근 바이러스학의 발전과 더불어 효과적인 PRRS백신을 개발하기 위한 무수한 연구와 도전이 진행중에 있습니다. 과학의 발전을 통해 오랫동안 우리 양돈농가를 괴롭혀온 이 PRRS를 박멸할 새로운 백신의 등장을 기대해봅니다.
[1] Brar MS et al. Evolutionary diversification of type 2 porcine reproductive and respiratory syndrome virus. 2015. Journal of General Virology. 96: 1570-1580.
[2] Infectious cDNA clone of North American porcine reproductive and respiratory syndrome (PRRS) virus and uses thereof. 1998. US patent. US6500662 B1.
[3] YY Ni et al. Computer-aided codon-pairs deoptimization of the major envelope GP5 gene attenuates porcine reproductive and respiratory syndrome virus. 2014. Virology. 450-451: 132-139.